Ацетоуксусный эфир
| Ацетоуксусный эфир | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | Этил-3-оксобутаноат |
| Традиционные названия | Этилацетоуксусный эфир, этиловый эфир ацетоуксусной кислоты, этилацетоацетат |
| Хим. формула | CH3COCH2COOС2Н5 |
| Рац. формула | C6H10O3 |
| Физические свойства | |
| Состояние | бесцветная жидкость с фруктовым запахом |
| Молярная масса | 130,1418 ± 0,0064 г/моль |
| Плотность | 1,0284 г/см³ |
| Термические свойства | |
| Т. плав. | -45 °C |
| Т. кип. | 180,8 °C |
| Т. всп. | 84 °C |
| Т. свспл. | 304 °C |
| Пр. взрв. | 9,5 % |
| Давление пара | 100 Па при 20 °С |
| Химические свойства | |
| pKa | 10,68 (в воде), 14,2 (в ДМСО) |
Растворимость в воде | 2,86 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4198 |
| Классификация | |
| Рег. номер CAS | 141-97-9 |
| PubChem | 8868 |
| Рег. номер EINECS | 205-516-1 |
| SMILES | CCOC(=O)CC(=O)C |
| InChI | 1S/C6H10O3/c1-3-9-6(8)4-5(2)7/h3-4H2,1-2H3 XYIBRDXRRQCHLP-UHFFFAOYSA-N |
| RTECS | AK5250000 |
| ChEBI | 4893 |
| ChemSpider | 13865426 |
| Безопасность | |
| ЛД50 | 3895 мг/кг (крысы, перорально) |
| Токсичность | Слаботоксичен, высокотоксичен при действии на кожу, ирритант  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Ацетоуксусный эфир , также этиловый эфир ацетоуксусной кислоты, этилацетоацетат — органическое соединение, сложный эфир, бесцветная подвижная жидкость со своеобразным нерезким запахом. Растворяется в воде (14,3 % при 16,5 °C), смешивается с этанолом и диэтиловым эфиром.
Содержание
1 Свойства
2 Синтез
3 Применение
4 Биологическое действие
5 Примечания
6 Литература
7 Ссылки
Свойства |
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
 ,
,
Согласно правилу Эльтекова енольные формы карбонильных соединений неустойчивы. Однако в ряде случаев енольные формы могут быть достаточно стабильными. Например, енольный таутомер стабилизирован за счет образования сопряжённой системы ( (H):О—C(CH3)=C(H) —C(:OC2H5)=O: ; см. 2-ю формулу енольной формы на рис., R — CH3, R’ — C2H5) и внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом.
Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 % (кетонной — 92,5 %). Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %.
Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом).
Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома.
Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + ROCl →{displaystyle to } CH3(ROO)C=CHCOOC2H5 + HCl
При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты:
- CH3(HO)C=CHCOOC2H5 + PCl5→{displaystyle to } CH3ClC=CHCOOC2H5 + POCl3 + HCl
С металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашенный в пурпурный цвет комплекс:
Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона:
Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона.
Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные:
- CH3COCH2COOC2H5 + EtONa →{displaystyle to } CH3COCH-COOC2H5 Na+ + EtOH
- CH3COCH-COOC2H5 Na+ + RHal →{displaystyle to } CH3COCHRCOOC2H5 + NaHal
В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты[1]:
2  | →  |
| Ацетоуксусный эфир | Дегидроацетовая кислота |
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию изодегидроацетовой кислоты[2].
Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксусной кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона:
- CH3COCH2COOC2H5 + H2O →{displaystyle to } CH3COCH2COOH + C2H5OH
- CH3COCH2COOH →{displaystyle to } CH3COCH3 + CO2 + H2O
Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов.
Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира:
- CH3COCHRCOOC2H5 + OH- + H2O →{displaystyle to } CH3COO- + RCH2COOH + C2H5OH
Синтез |
Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсация этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[3]:
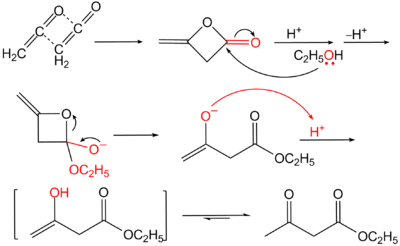
Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза:
Применение |
Ацетоуксусный эфир широко применяется в органическом синтезе.
Алкилирование натрийацетоуксусного эфира 2 с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров 3 используется как препаративный метод синтеза метилкетонов 4 и замещенных уксусных кислот 5:
Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), ряда органических веществ.
В фотографии использовался как жёлтая диффундирующая цветообразующая компонента, образующая краситель в процессе цветного фотографического проявления[4].
Биологическое действие |
Обладает кожнораздражающим действием. Всасывается через кожу. ПДК 1 мг/м³
Примечания |
↑ F. Arndt. Dehydroacetic acid. Organic Syntheses, Coll. Vol. 3, p.231 (1955); Vol. 20, p.26 (1940).
↑ Newton R. Smith, Richard H. Wiley. Isodehydroacetic acid and ethyl isodehydroacetate. Organic Syntheses, Coll. Vol. 4, p.549 (1963); Vol. 32, p.76 (1952).
↑ С.В.Пономарев, А.С.Золотарева, Л.Г.Сагинова, В.И.Теренин "Практикум по органической химии"
↑ Венкатараман, 1957, с. 1374-1375.
Литература |
- Венкатараман К. Химия синтетических красителей. — Л.: Государственное научно-техническое издательство химической литературы, 1957. — Т. 2.
Ссылки |
- Ацетоуксусный эфир // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Для улучшения этой статьи желательно: |
 ,
,