Бензойная кислота
| Бензойная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование | бензойная кислота |
| Традиционные названия | бензойная кислота |
| Хим. формула | C6H5COOH |
| Рац. формула | C7H6O2 |
| Физические свойства | |
| Состояние | твёрдая |
| Молярная масса | 122.12 г/моль |
| Плотность | 1.32 г/см³ |
| Термические свойства | |
| Т. плав. | 122.4 °C |
| Т. кип. | 249.2 °C |
.mw-parser-output .ts-comment-commentedText{border-bottom:1px dotted;cursor:help}@media(hover:none){.mw-parser-output .ts-comment-commentedText:not(.rt-commentedText){border-bottom:0;cursor:auto}} Т. разл. | 370 °C |
| Т. всп. | 121 градус Цельсия[1] |
| Т. свспл. | 570 градус Цельсия[1] |
| Удельная теплота испарения | 527 Дж/кг |
| Удельная теплота плавления | 18 Дж/кг |
| Химические свойства | |
| pKa | 4.20 |
Растворимость в воде | 0,29 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,504[2] |
| Структура | |
| Дипольный момент | 1.72 Д |
| Классификация | |
| Рег. номер CAS | 65-85-0 |
| PubChem | 243 |
| Рег. номер EINECS | 200-618-2 |
| SMILES | C1=CC=C(C=C1)C(=O)O |
| InChI | 1S/C7H6O2/c8-7(9)6-4-2-1-3-5-6/h1-5H,(H,8,9) WPYMKLBDIGXBTP-UHFFFAOYSA-N |
| Кодекс Алиментариус | E210 |
| RTECS | DG0875000 |
| ChEBI | 30746 и 41051 |
| ChemSpider | 238 |
| Безопасность | |
| Токсичность | LD50 500 mg·kg−1 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бензо́йная кислота́ C6H5СООН — простейшая одноосновная карбоновая кислота ароматического ряда.
Содержание
1 История
2 Физические свойства
3 Получение
4 Лабораторный синтез и очистка
4.1 Гидролиз
4.2 Реакция Канниццаро
4.3 Реакция Гриньяра
4.4 Окисление
5 История получения
6 Применение
6.1 Калориметрия
6.2 Сырьё
6.3 Консервант
6.4 Медицина
6.5 Другие применения
7 Биологическое действие и влияние на здоровье человека
7.1 Бензольное кольцо
7.2 Карбоксильная группа
8 Производные
8.1 Соли
9 Примечания
10 Ссылки
11 Примечания
История |
Впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Блеза де Виженера (1596).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Физические свойства |
Бензойная кислота — белые кристаллы, плохо растворимые в воде, хорошо — в этаноле, хлороформе и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой (pKa 4,21).
Чистая кислота имеет температуру плавления 122,4 °C, температуру кипения 249 °C.
Легко возгоняется; перегоняется с водяным паром, поэтому неэффективно повышать концентрацию водных растворов бензойной кислоты упариванием раствора.
Получение |
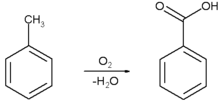
Бензойную кислоту можно получить окислением толуола сильными окислителями, такими, например, как перманганат калия, оксид хрома (VI), азотная или хромовая кислота, а также декарбоксилированием фталевой кислоты.
В промышленных масштабах бензойную кислоту получают окислением толуола кислородом на катализаторе (нафтената марганца или кобальта).
Лабораторный синтез и очистка |
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Гидролиз |
Бензамид и бензонитрил гидролизуются в воде в присутствии кислоты или основания до бензойной кислоты.
Реакция Канниццаро |
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.

Реакция Гриньяра |
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
- C6H5MgBr+CO2→C6H5COOMgBr{displaystyle {mathsf {C_{6}H_{5}MgBr+CO_{2}rightarrow C_{6}H_{5}COOMgBr}}}
- C6H5COOMgBr+HCl→C6H5COOH+MgBrCl{displaystyle {mathsf {C_{6}H_{5}COOMgBr+HClrightarrow C_{6}H_{5}COOH+MgBrCl}}}
Окисление |
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
- 5C6H5CH3+6KMnO4+9H2SO4→5C6H5COOH+3K2SO4+6MnSO4+14H2O{displaystyle {mathsf {5C_{6}H_{5}CH_{3}+6KMnO_{4}+9H_{2}SO_{4}rightarrow 5C_{6}H_{5}COOH+3K_{2}SO_{4}+6MnSO_{4}+14H_{2}O}}}
- 5C6H5CH2OH+4KMnO4+6H2SO4→5C6H5COOH+4MnSO4+2K2SO4+11H2O{displaystyle {mathsf {5C_{6}H_{5}CH_{2}OH+4KMnO_{4}+6H_{2}SO_{4}rightarrow 5C_{6}H_{5}COOH+4MnSO_{4}+2K_{2}SO_{4}+11H_{2}O}}}
История получения |
Первый производственный процесс включал в себя гидролиз бензолтрихлорида под действием гидроксида кальция в воде в присутствии железа или его солей в качестве катализатора. Образующийся бензоат кальция переводили в бензойную кислоту обработкой соляной кислотой. Продукт содержал значительное количество хлорпроизводных бензойной кислоты, поэтому не использовался в качестве пищевой добавки. В настоящее время в пищу используется бензойная кислота, получаемая синтетически.
Применение |
Калориметрия |
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё |
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5. C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.- Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол. Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура, может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант |
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина |
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения |
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
Биологическое действие и влияние на здоровье человека |
Бензойная кислота в свободном виде и виде сложных эфиров встречается в составе многих растений и животных. Значительное количество бензойной кислоты находится в ягодах (около 0,05 %). Зрелые плоды некоторых видов вакциниума содержат большое количество свободной бензойной кислоты. Например, в бруснике — до 0,20 % в спелых ягодах, и в клюкве — до 0,063 %. Бензойная кислота также образуется в яблоках после заражения грибком Nectria galligena. Среди животных, бензойная кислота обнаружена в основном во всеядных или фитофагных видах, например, во внутренних органах и мускулах тундряной куропатки (Lagopus muta), также как и в выделениях самцов овцебыка или азиатского слона.
Бензойная смола содержит до 20 % бензойной кислоты и 40 % бензойных эфиров.
Бензойная кислота присутствует, как часть гиппуровой кислоты (N-бензоилглицин) в моче млекопитающих, особенно травоядных животных. Бензойная кислота хорошо всасывается, через коэнзим А связывается с аминокислотой глицином в гиппуровую кислоту и в таком виде выводится через почки. Человек выделяет около 0,44 г/л гиппуровой кислоты в день в моче и больше, если находится в контакте с толуолом или бензойной кислотой.
Для человека считается безопасным потребление 5 мг/кг массы тела в день. Кошки имеют гораздо более низкую толерантность к бензойной кислоте, чем мыши и крысы. Летальная доза для кошек — 300 мг/кг массы тела. Оральная ЛД50 для крыс 3040 мг/кг, для мышей 1940—2260 мг/кг.
Бензольное кольцо |
Электрофильное ароматическое присоединение происходит по 3-му положению из-за электроноакцепторных свойств карбоксильной группы. Второе замещение происходит сложнее (правая часть) благодаря деактивации нитрогруппой. Наоборот, при введении электронодонорного заместителя (например, алкила), второе замещение происходит легче.
Карбоксильная группа |
Все реакции характерные для карбоксильной группы возможны с бензойной кислотой:
- Эфиры бензойной кислоты — продукты кислотнокатализируемой реакции со спиртами
- Амиды бензойной кислоты легко доступны, используя для их синтеза активированные производные(такие как бензоилхлорид), или сочетающие реагенты используемые в пептидном синтезе такие как ДЦГК и ДМАП.
- Более активный бензойный ангидрид образуется при дегидратации уксусным ангидридом или оксидом фосфора
- Высокоактивные галогенангидриды легко получаются действием хлоридом фосфора(V) или тионилхлорида
Ортоэфиры могут быть получены в сухих условиях реакцией бензонитрила в кислой среде со спиртами- Восстановление до бензальдегида или бензилового спирта возможно при использовании LiAlH4 или борогидрида натрия
Декарбоксилирование серебряной соли может быть проведено при нагревании, бензойная кислота может быть декарбоксилирована при нагревании с сухими щёлочами или гидроксидом кальция.- Бензойная кислота образует соли
Производные |
2,3-дигидроксибензойная кислота (пирокатехиновая кислота)- 2,4-дигидроксибензойная кислота (бета-резорциловая кислота)
2,5-дигидроксибензойная кислота (гентизиновая кислота)- 2,6-дигидроксибензойная кислота (гамма-резорциловая кислота)
3,4-дигидроксибензойная кислота (протокатехиновая кислота)- 3,5-дигидроксибензойная кислота (альфа-резорциловая кислота)
- 3-нитробензойная кислота
- 3,5-динитробензойная кислота
- Толуиловые кислоты
Соли |
Соли бензойной кислоты называются бензоатами, например:
- Бензоат аммония
- Бензоат лития
- Бензоат натрия
- Бензоат магния
- Бензоат марганца
- Бензоат меди(II)
- Бензоат ртути(II)
- Бензоат свинца(II)
- Бензоат серебра
Примечания |
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Бензойная кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки |
- Елена Шаталова. "Среда обитания". "Продукты вечной молодости" (неопр.) (недоступная ссылка). — Программа Первого канала. Проверено 22 ноября 2011. Архивировано 5 февраля 2012 года.
- http://www.nordspb.ru/benzoesaure
Примечания |
↑ 12 CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 16–18. — ISBN 978-1-4987-5428-6<a href="https://wikidata.org/wiki/Track:Q9551942"></a><a href="https://wikidata.org/wiki/Track:Q42107747"></a><a href="https://wikidata.org/wiki/Track:Q29422"></a>
↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 97 — Boca Raton: 2016. — P. 3–40. — ISBN 978-1-4987-5428-6<a href="https://wikidata.org/wiki/Track:Q9551942"></a><a href="https://wikidata.org/wiki/Track:Q42107747"></a><a href="https://wikidata.org/wiki/Track:Q29422"></a>